关于兽用生物制品经营管理办法(修订草案征求意见稿)的说明一、修订背景
现行《兽用生物制品经营管理办法》于2007年5月1日正式实施,对规范兽用生物制品经营行为、保障兽用生物制品质量发挥了重要作用,同时也为推动重大动物疫病防控工作顺利开展发挥了积极作用。
为适应新形势下动物疫病防控工作需求,国家研究提出了强制免疫疫苗“先打后补”政策,选择部分省份开展试点并取得积极进展。现行办法规定生产企业只能将国家强制免疫用生物制品销售给省级人民政府兽医行政管理部门和符合规定的养殖场,不得向其他单位和个人销售,给推广“先打后补”政策带来一定不便。为适应下阶段全面推行“先打后补”政策需求,我们组织对现行办法进行了修订,重点调整现行兽用生物制品经营管理制度,完善国家强制免疫用生物制品经营方式,与“先打后补”政策做好衔接,推动重大动物疫病防控工作顺利开展。同时对兽用生物制品经销机制进行了优化,增加了冷链运输和追溯要求,进一步保障兽用生物制品质量安全。
二、主要修订内容
(一)放开国家强制免疫用生物制品经营。实施“先打后补”政策后,养殖场(户)需要方便、及时地购买到国家强制免疫用生物制品,现行办法的经营限制规定已不能适应当前防控工作需要。因此,征求意见稿允许兽用生物制品生产企业可将本企业生产的兽用生物制品(不再区分强免与非强免)销售给各级人民政府畜牧兽医行政管理部门或使用者,也可授权其经销商销售。
(二)优化兽用生物制品经销机制。现行办法规定经销商只能将所代理的产品销售给使用者,不得销售给其他兽药经营企业。此规定与我国当前养殖分散模式不相适应,不利于养殖场(户)就近购买。因此,征求意见稿允许两级经营,一级经销商可向二级经销商销售兽用生物制品,一级经销商和二级经销商均可向养殖场(户)销售兽用生物制品。通过拓宽二级经销商覆盖范围,方便养殖场(户)就近购买所需的兽用生物制品。
(三)增加冷链贮存运输和追溯管理要求。兽用生物制品的贮存、运输条件直接影响其质量,进而影响免疫效果,近年来的监督检验结果也显示在经营使用环节多次出现质量不合格问题。为强化冷链管理,确保兽用生物制品质量,征求意见稿要求生产、经营企业建立冷链贮存运输制度,自行配送或委托配送时,均应确保兽用生物制品处于规定的温度环境。同时,征求意见稿增加了追溯管理要求,要求生产企业、经营企业以及国家强制免疫用生物制品采购、分发单位均应及时上传相关数据信息。
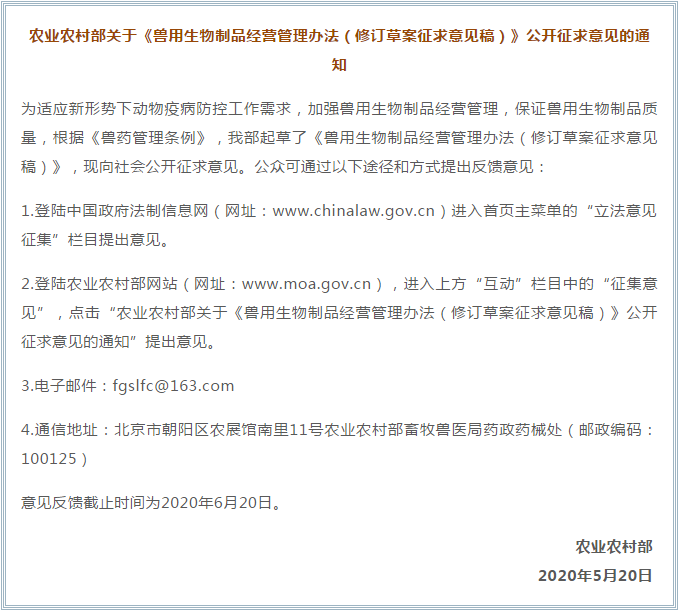
兽用生物制品经营管理办法(修订草案征求意见稿)
第一条 为加强兽用生物制品经营管理,保证兽用生物制品质量,根据《兽药管理条例》,制定本办法。
第二条 在中华人民共和国境内从事兽用生物制品的分发、经营和监督管理,应当遵守本办法。
第三条 本办法所称兽用生物制品是指以天然或者人工改造的微生物、寄生虫、生物毒素或者生物组织及代谢产物等为材料,采用生物学、分子生物学或者生物化学、生物工程等相应技术制成的,用于预防、治疗、诊断动物疫病或者有目的地调节动物生理机能的兽药。
第四条 兽用生物制品分为国家强制免疫计划所需兽用生物制品(以下简称国家强制免疫用生物制品)和非国家强制免疫计划所需兽用生物制品(以下简称非国家强制免疫用生物制品)。
国家强制免疫用生物制品品种名录由农业农村部确定并公布。非国家强制免疫用生物制品是指农业农村部确定的强制免疫用生物制品以外的兽用生物制品。
第五条 农业农村部负责全国兽用生物制品的监督管理工作。
县级以上地方人民政府畜牧兽医行政管理部门负责本行政区域内兽用生物制品的监督管理工作。
第六条 兽用生物制品生产企业可以将本企业生产的兽用生物制品销售给各级人民政府畜牧兽医行政管理部门或使用者,也可授权其经销商销售。
发生重大动物疫情、灾情或者其他突发事件时,根据工作需要,国家强制免疫用生物制品由农业农村部统一调用,生产企业不得自行销售。
第七条 从事兽用生物制品经营的,应当依法取得《兽药经营许可证》。《兽药经营许可证》的经营范围应当载明国家强制免疫用生物制品、非国家强制免疫用生物制品。经营范围发生变化的,应当办理变更手续。
第八条 兽用生物制品生产企业可自主确定、调整授权经销商,并与授权经销商签订授权书,明确授权产品名称、授权有效期限以及授权经销商等级等事项。
经销商分为一级和二级两个等级。一级经销商可将获得授权销售的兽用生物制品销售给使用者,也可销售给获得相应兽用生物制品授权的二级经销商。二级经销商只能将获得授权的兽用生物制品销售给使用者。
第九条 省级人民政府畜牧兽医行政管理部门对国家强制免疫用生物制品可依法实行政府采购并组织分发。
承担国家强制免疫用生物制品政府采购、分发任务的单位,应当建立国家强制免疫用生物制品贮存、运输、分发等管理制度,建立真实、完整的分发和冷链运输记录,记录应当保存至兽用生物制品有效期满后2年。
第十条 向国家强制免疫用生物制品生产企业或其授权的经销商采购自用的国家强制免疫用生物制品的养殖场(户),应当将采购的品种、生产企业、数量向所在地县级地方人民政府畜牧兽医管理部门备案。
养殖场(户)应当建立真实、完整的采购、贮存、使用记录,并保存至制品有效期满后2年。贮存条件应符合制品贮存条件要求。
第十一条 兽用生物制品生产、经营企业应当建立真实、完整的贮存、销售、冷链运输记录。销售记录应当载明产品名称、产品批号、产品规格、产品数量、生产日期、有效期、收货单位和地址、发货日期等内容。冷链运输记录应当准确记录起运和到达时的温度。
兽用生物制品生产企业在销售兽用生物制品时,应当向购买者提供加盖企业印章的批签发证明文件复印件或电子文件。购买者应当保存加盖企业印章的批签发证明文件复印件或电子文件至产品有效期满后2年。
第十二条 兽用生物制品生产、经营企业自行配送兽用生物制品,应当具备相应的冷链贮存、运输条件,也可委托具备相应冷链贮存、运输条件的配送单位配送,但应对委托配送的产品质量负责。冷链贮存、运输全过程应当处于规定的贮藏温度环境下。
第十三条 兽用生物制品生产、经营企业以及承担国家强制免疫用生物制品政府采购、分发任务的单位,应当按照兽药追溯要求及时、准确、完整地上传生物制品入库、出库追溯数据至国家兽药追溯系统。
第十四条 兽药经营企业无兽用生物制品经营范围的,不得经营兽用生物制品。兽药经营企业只能经营获得兽用生物制品生产企业授权销售的兽用生物制品,不得超范围经营未获得授权的兽用生物制品。
获得销售兽用生物制品授权的兽药经营企业应将授权书报发证机关备案。
第十五条 县级以上地方人民政府畜牧兽医行政管理部门应当依法加强对兽用生物制品生产、经营企业和使用者监督检查,发现有违反《兽药管理条例》和本办法规定情形的,应当依法做出处理决定或者报告上级畜牧兽医行政管理部门。
第十六条 各级畜牧兽医行政管理部门、兽药检验机构、动物卫生监督机构、动物疫病预防控制机构及其工作人员,不得参与兽用生物制品生产、经营活动,不得以其名义推荐或者监制、监销兽用生物制品和进行广告宣传。
第十七条 养殖场(户)、动物诊疗机构等使用者采购的或者经政府分发获得的兽用生物制品只限自用,不得转手销售。
养殖场(户)、动物诊疗机构等使用者转手销售兽用生物制品的,或者兽药经营企业超出《兽药经营许可证》载明的经营范围经营兽用生物制品的,属于无证经营,按照《兽药管理条例》第五十六条的规定处罚。
第十八条 进口兽用生物制品的经营管理适用《兽药进口管理办法》。
第十九条 本办法自2020年 月 日起施行。原《兽用生物制品经营管理办法》(2007年3月29日 农业部令第3号公布)同时废止。
来源:农业农村部
声明:转载自其它平台或媒体文章,本平台将注明来源及作者,但本平台不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证,仅作参考。若侵犯著作权,请主动联系本平台并提供相关书面证据,本平台将更正来源及作者或依据著作权人意见删除该文章,并不承担其他任何责任。
责任编辑:李金霞

在微信中长按识别上图二维码,
或找小牧民 13971591889
加入垄上畜牧社群!





请输入验证码